每日經濟新聞 2021-01-08 08:58:16
每經記者 文巧 每經編輯 高涵

1961年,在加州理工學院的一個實驗室,科學家首次成功提取到mRNA;1990年,威斯康星大學的科研團隊首次發現,將體外轉錄的mRNA注射至小鼠骨骼肌內,可以表達相應蛋白質并產生免疫反應,震驚學術界。
關于mRNA技術的理想藍圖就此展開,雖然那時已有科學家預測mRNA療法將在未來占據重要地位,但所有人并不知道,在幾十年后的今天,mRNA在這場新冠疫情中掀起如此巨大的風浪。在輝瑞/BioNTech的新冠疫苗獲批緊急使用前,這項技術尚未誕生過一款疫苗或者療法被廣泛使用。
當地時間2020年12月31日晚,世界衛生組織將輝瑞/BioNTech的mRNA疫苗列為可緊急使用,這是首個獲世衛緊急使用授權的新冠疫苗。此前,美國、英國、加拿大和歐盟等都已批準輝瑞/BioNTech疫苗的使用或者上市。此外,美國還授權緊急使用Moderna的mRNA疫苗。
在新冠疫苗研發全球競賽中,基于mRNA技術的疫苗是首批進入臨床試驗的先鋒之一。輝瑞/BioNTech和Moderna新冠疫苗強勁的初期研究結果也讓他們在資本市場大放異彩,BioNTech和Moderna公司股價較去年年初分別飆升約160%和490%。
近日,特斯拉CEO埃隆·馬斯克(Elon Musk)在接受Business Insider訪談時表示,mRNA疫苗尤其有趣,因為mRNA技術可能是癌癥的潛在治愈方法。“醫學的未來是mRNA,基本上,你可以使用mRNA治愈一切。它就像一個電腦程序,你可以對其進行編程以執行所需的任何操作。你甚至都可以變成蝴蝶。”
馬斯克此前曾宣布,特斯拉將“為總部位于德國的CureVac 公司打造RNA 微型工廠”。據悉,特斯拉建立的RNA生物反應器(RNA Bioreactor)可以制造疫苗及生產藥物。
BioNTech在接受《每日經濟新聞》記者采訪時表示,mRNA疫苗的獲批對于整個行業來說,可能成為引發藥理革命的重要時刻。以mRNA技術為基礎的治療手段,將可能以更快的速度被應用于其他重要領域,特別是癌癥治療。
沉寂數十載,一朝聲名大噪,mRNA技術背后有著怎樣的故事?它對于疫苗行業甚至整個生物科技行業意味著什么?未來還有哪些更廣闊的應用?

給病毒“畫像”:極大縮短制備時間

圖片來源:攝圖網
2020年,為對抗新冠疫情,全球掀起一場新冠疫苗研發競賽,包括mRNA疫苗、滅活疫苗、重組蛋白疫苗、亞單位疫苗、病毒載體疫苗和DNA疫苗在內的多條新冠疫苗技術路線并進。
所有疫苗無非都基于一個相同的思路:誘導免疫系統產生免疫反應以阻斷病毒。
“當使用傳統疫苗(減毒病原體、滅活病原體或蛋白質亞基)進行免疫時,疫苗中會包含會誘導免疫反應的實際抗原。” 賓夕法尼亞大學醫學教授、mRNA療法專家諾伯特•帕迪(Norbert Pardi)向《每日經濟新聞》記者說道,“而當使用mRNA疫苗進行免疫時,它相當于為免疫系統提供一個藍圖,也就是說mRNA編碼了蛋白質抗原,由宿主細胞生產這種抗原,并誘導免疫反應。”相當于給病毒畫了幅肖像畫,讓免疫細胞去識別,引起機體免疫反應。
簡單來說,傳統疫苗向人體直接注射蛋白質抗原,而mRNA疫苗則使用病毒的獨特遺傳片段轉錄合成為mRNA——信使核糖核酸,作為決定身體機能的遺傳數據庫DNA和構成生命有機體蛋白質的生成之間的中介,它能夠接受DNA中的指示,并將其傳遞給細胞,從而在體內制造特定的蛋白質。
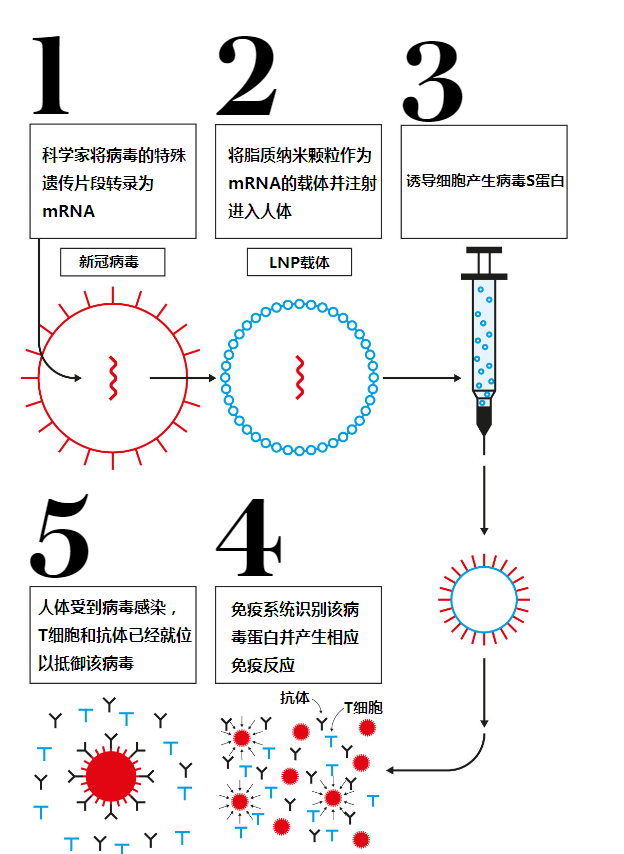
mRNA疫苗工作機制 圖片來源:The Telegraph
因而,傳統的疫苗路線通常要在體外環境中培養病毒,依賴細胞擴增的過程,需要更長的制備時間;而mRNA疫苗只需要利用病毒的基因序列合成相關序列的mRNA,從而先期合成更快。
“在拿到病毒序列之后,僅用了42天就制備出mRNA候選疫苗。”Moderna創始人之一、前哈佛醫學院副教授德里克·羅西(Derrick Rossi)在發給《每日經濟新聞》記者的一封郵件中透露。
相比之下,傳統的疫苗通常只誘導產生抗體,而mRNA疫苗還可以誘導產生細胞免疫反應。BioNTech公司此前在接受每經記者采訪時說道,“mRNA具有高度免疫原性,可以誘導產生中和抗體以及T細胞免疫雙重機制,而不需要額外的佐劑。”
既然mRNA疫苗是使用病毒的特殊遺傳片段,那么隨之而來的問題是,應當選擇病毒的哪一部分在細胞內進行表達?
2020年2月19日,知名學術期刊《科學》發表了一篇論文,來自美國得克薩斯大學奧斯汀分校的McLellan實驗室團隊首次利用冷凍電鏡展示了新冠病毒刺突蛋白的3D分子結構,確認刺突蛋白結構是疫苗應對的關鍵區域。
該實驗團隊的分子生物學博士Wang Nianshuang在此前接受《每日經濟新聞》記者采訪時表示,“了解病毒背后的機制就能更好地指導疫苗研發,我們使用一種‘基于結構的疫苗設計’的概念來獲取疫苗。”
據Wang Nianshuang介紹,在此前他們已經開發出一種通用策略,開發出具有增強表達、穩定性和免疫原性的SARS和MERS刺突蛋白。新冠疫情暴發后,基于這一策略,他們迅速獲得了新冠病毒刺突蛋白的3D分子結構,并能改造這種蛋白,為獲得更優良性能的疫苗服務。
新冠病毒刺突蛋白隨即成為mRNA疫苗突破的關鍵,科學家將其作為病毒的特殊遺傳片段合成mRNA,使人體細胞在體內合成該刺突蛋白,并訓練免疫系統產生免疫反應。
近日,新冠肺炎病毒變異毒株感染病例先后在英國、南非、加拿大、日本和歐洲多個國家出現。研究發現,英國的變異毒株觀察到17個刺突蛋白突變。而刺突蛋白作為mRNA疫苗在細胞內表達的重要部分,其發生突變對mRNA疫苗有效性是否產生影響引起了廣泛關注。
帕迪告訴記者,目前并未發現任何變異毒株可以逃避mRNA疫苗誘導的中和抗體反應。“雖然也有可能產生疫苗逃逸突變體,但這種可能性較小。即使發生,我們也能很快地調整mRNA疫苗。”

打破范式:科學家的接力


圖片來源:每經記者 王昊毅 攝 資料圖
以往,疫苗開發通常需要數年甚至數十年的時間,而在過去的十多個月中,mRNA疫苗取得的進展改變了已有的范式,為疫苗開發創建了新的模式,并可能在未來的數年內幫助人類抵御新興的、未知的病毒。
然而,mRNA新冠疫苗并非一次突然的“尤里卡時刻”,實際上,這項技術已經默默無聞地發展了幾十年的時間。
1961年5月,《自然》雜志上刊登了兩篇科學論文,以法國生物學家François Jacob和南非分子生物學家和遺傳學家Sydney Brenner為首的9名科學家宣布成功分離mRNA。
同月,François Jacob和另一位法國生物學家Jacques Monod在《分子生物學雜志》上發表綜述,在理論的背景之下討論了mRNA在基因調控中可能發揮的巨大作用。
他們認為,結構基因決定了蛋白質的分子組成,調節基因和操縱基因通過細胞質成分或阻遏物的中介來控制蛋白質的合成速度,阻遏物可以被某些特定的代謝物誘導或抑制。一種信使基因在這種調節系統中起直接作用,該信使基因與發生蛋白質合成的核糖體有關,也就是現在所說的mRNA。彼時,科學界認為這篇文章“極具想象力”,因為它代表了一種全新的有關基因功能的思維模式。
將近30年后,1990年,美國科學家 Jon Wolff等人發表的論文證實,將體外轉錄的mRNA注射至小鼠骨骼肌內,可以在其肌肉細胞內產生相應表達的蛋白質,并產生免疫反應。整個科學界為這一發現震驚、歡呼,一個有關mRNA的構想從此生根發芽,在此后的數十年中不斷成長壯大。
匈牙利生物學家卡塔琳·卡里科(Katalin Karikó)是這條探索路上的先驅者之一,她與賓夕法尼亞大學醫學教授、免疫學家德魯•韋斯曼(Drew Weissman)的突破性發現為輝瑞/BioNTech和Moderna疫苗的問世鋪平了道路,并可能為新的醫學療法打開一扇新的大門。
1978年,卡里科在匈牙利的塞格德生物研究中心從事mRNA相關研究。不幸的是,當時mRNA技術并未受到青睞,卡里科的研究也未能吸引到科研經費,她在1985年被迫離職。
“這是一段困難的時光,人們并不相信mRNA可以成為一種療法。”卡里科說道。
Jon Wolff實驗團隊的發現讓卡里科再次看到了mRNA的無限潛能。1990年,她在賓夕法尼亞大學開始了針對囊性纖維化、中風等疾病的mRNA 相關療法的研究。最終,卡里科依然未能獲得研究經費,她在1995年被迫降職。
實際上,自1990年以來,科學家們一直嘗試向實驗動物注射合成mRNA。盡管mRNA療法研究深耕多年,但進展十分緩慢。在輝瑞/BioNTech、Moderna新冠疫苗之前,還未有一款mRNA藥物或疫苗正式獲批上市。
“mRNA療法的研發進展非常緩慢,因為有兩個主要的障礙需要克服。” 帕迪解釋道。
一個問題在于mRNA的不穩定性和易降解性,合成mRNA可能在達到靶細胞之前被破壞,由此可能對某些患者構成炎癥或其他健康風險;另一個問題則在于早期缺乏可以保護mRNA免于快速降解的安全有效的載體分子。
第一個問題也是最主要的障礙,由于免疫系統將注入的分子視為“外來侵入者”,觸發了激進的免疫反應導致致命的炎癥,諸多研究或以失敗告終,或停滯不前,許多科學家也因此放棄了這一構思。
但卡里科堅持了下來,十余年后,這一困擾醫學界多年的謎題終于迎來了解碼的鑰匙。

諾獎級發現:修飾mRNA


圖片來源:攝圖網
在賓夕法尼亞大學工作的期間,卡里科遇到了韋斯曼。
彼時,韋斯曼在美國國立衛生研究院(NIH)的福西(Fauci)實驗室進行了一項涉及免疫細胞和疫苗反應的研究,他請求卡里科為其設想的HIV疫苗合成一些mRNA。正是這場合作,為解決mRNA引發的嚴重炎癥問題埋下了重要伏筆。
2005年,卡里科和韋斯曼發現了一種針對mRNA致命弱點的補救方法——修飾核苷mRNA。
mRNA的每條鏈均由四個稱為核苷的分子構建單元組成,他們將其中一個替換為修飾后的核苷,創建了一種雜交mRNA,該mRNA可以潛入細胞中而不會導致細胞防御引起的炎癥問題。
“在人體內有17種不同的‘傳感器’或者說蛋白質,可以識別RNA,我們修飾了RNA,因此它們無法再識別,也不會觸發激進的免疫反應。”韋斯曼表示。
這一發現在一系列科學論文中進行了論述,雖然在當時并未引起很多人的注意,但成功地吸引了羅西的關注。他認為這一發現是開創性的,直至今日,他仍堅持卡里科和韋斯曼是諾貝爾化學獎的第一人選。
與此同時,自60年代開始,科學家就一直在研究封裝、遞送大型分子的方法,這項技術發展了數十年,但是mRNA提出了比其他分子更大的挑戰。
“這是一個更難的任務,因為mRNA分子更大,且更加不穩定。” Moderna創始人之一、麻省理工學院生物工程師羅伯特·蘭格(Robert Langer)在接受媒體采訪時表示。
2015年,帕迪和韋斯曼首次描述了將脂質納米顆粒(LNP)作為mRNA的載體。“LNP的作用就是保護mRNA,防止其降解,同時幫助mRNA順利進入細胞。”羅西解釋。
至此,mRNA療法發展史上面臨的最艱巨的兩大難題迎刃而解,這也為后來的mRNA疫苗研究開辟了道路。
"如今,輝瑞/BioNTech和Moderna疫苗都使用核苷修飾的mRNA,且兩種疫苗都使用LNP作為載體。”帕迪告訴記者。
他進一步表示:“核苷修飾的mRNA-LNP疫苗是一項新興技術,2017年才第一次發表這種疫苗的動物研究結果。一般來講,開發新疫苗需要8~10年的時間,主要是因為測試和評估疫苗需要很長時間。但由于新冠疫情,我們不得不將疫苗的開發縮減到不到一年的時間內。技術的進步,科學家的辛勤工作,政府和公司的支持,對于這一成功至關重要。”
不過,LNP也有在少數人體內引發過敏反應的可能性。FDA的報告顯示,注射輝瑞/BioNTech和Moderna疫苗都可能出現惡心、疲勞、頭痛和肌肉疼痛等副作用,引起公眾對mRNA疫苗安全性的擔憂。
羅西認為,包括發燒、頭痛和肌肉痛等副作用是常見的,可能是由于LNP載體引發的過敏性反應。“但迄今為止的臨床試驗數據表明,mRNA疫苗非常有效且安全。”他告訴記者。同時他也坦言,mRNA疫苗對病毒的防護將持續多長時間尚不清楚,還有待進一步觀察。
帕迪則向記者表示,受試者可能對疫苗的某些成分過敏,但幸運的是,這是非常罕見的事件,絕大多數人沒有這種反應。他認為,接下來需要克服的是溫度問題,希望能夠早日生產出可以在更高溫度下(4℃)儲存的mRNA疫苗。

“體內工廠”:重新定義疫苗

圖片來源:視覺中國
卡里科和韋斯曼里程碑式的發現為BioNTech和Moderna的誕生埋下了伏筆。
人體依靠數百萬種微小的蛋白質來維持自身的生命和健康,并利用mRNA來告訴細胞制造哪些蛋白質。在卡里科當年的設想中,從理論上講,如果能夠設計mRNA,人體內就擁有了一個蛋白質制造工廠,可以制造任何想要的蛋白質——抗感染的疫苗或抗體,治療罕見疾病的酶,或是修復受損組織的生長劑。
2008年,在德國萊茵河畔左岸的美因茨,一對土耳其裔科學家夫婦從看到了這項技術的巨大潛力,建立了一家基于mRNA技術的癌癥免疫療法公司——BioNTech。2013年,卡里科加入了BioNTech擔任高級副總裁,負責領導基于mRNA技術的蛋白質替代療法項目。
2010年,同樣從修飾核苷mRNA中看到了拯救數以萬計生命的希望,羅西與蘭格、風險投資公司企業家Noubar Afeyan等人共同創立了Moderna,Moderna即Modified RNA的縮寫。
對于mRNA技術未來的應用場景,BioNTech此前在接受《每日經濟新聞》記者采訪時說過,mRNA疫苗的獲批對于整個行業來說,可能成為引發藥理革命的重要時刻。以mRNA技術為基礎的治療手段,將可能以更快的速度被應用于其他重要領域,特別是癌癥治療。
帕迪向記者說道:“合成mRNA技術的真正妙處在于,你可以在mRNA上編碼任何蛋白質,并將其用于多種目的,例如疫苗、蛋白質替代甚至基因編輯。”除此之外,他告訴記者,mRNA的生產極為簡便,將來的成本應該會更低。
在麻省理工學院官網發表的一篇文章中,因發現斷裂基因和RNA剪接而獲得1993年諾貝爾生理學或醫學獎(Nobel Prize in Physiology or Medicine)的Phillip Sharp認為:“與其他傳統類型的疫苗相比,mRNA疫苗具有多重優勢,包括使用非感染性元素、大大縮短生產周期、更容易擴大生產規模等。雖然無法準確預測mRNA療法的未來,但有跡象表明,新進展將會很快發生,它將是現代醫療最前沿的療法之一。”
“幾年前,第一種基于RNA干擾的療法被批準用于治療致命性遺傳疾病,mRNA療法也可能將用于治療遺傳性疾病,制備針對癌癥的疫苗,甚至是生產可移植器官。未來,mRNA技術可能允許一種疫苗針對多種疾病,甚至可以根據個人基因組來創建個性化疫苗。”他如此說道。
從新冠疫苗起步,mRNA或將重新定義疫苗的研發技術。

記者手記|mRNA技術走向“前臺”
2020年初,為抗擊新冠疫情,全球掀起了一場疫苗研發競賽,Moderna公司研發的mRNA新冠疫苗率先邁入臨床試驗階段。彼時,有專家曾對記者表示,候選mRNA疫苗首先進行試驗,是因為它們是最容易設計和生產的候選疫苗之一,并不是因為它們最有成功的希望。
如今,mRNA新冠疫苗的大規模接種已經拉開帷幕。此前,mRNA技術的探索已經進行了數十年,但期間并未有一款mRNA疫苗或藥物正式獲批上市。mRNA新冠疫苗讓mRNA技術走向“前臺”,其影響已經超過了這場疫情本身。
在近期的相關采訪中,許多科學家認為mRNA新冠疫苗的開發挑戰了過去疫苗開發的整個范式;mRNA技術將顛覆疫苗行業,甚至將為整個生物科技領域帶來巨大變革。
抱著對mRNA技術的好奇,我們刊發了這篇報道,試圖揭開這一技術的“秘密”,也期待著mRNA技術能夠如許多人所預期的,深刻改變生物科技的未來。
記者:文巧
編輯:高涵
視頻編輯:祝裕
視覺:鄒利
排版:高涵 馬原
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
