每日經濟新聞 2022-08-19 19:57:30
◎PD-1競爭白熱化,君實生物旗下特瑞普利單抗大適應證獲批后能給公司貢獻多少收入,還有待觀察;而公司新冠口服藥VV116也正在沖刺上市,但上市后有多大應用市場,也是未知數。作為全球首個獲批臨床的抗BTLA單抗,如果后續臨床研究進展順利,JS004有望成為一款重磅的免疫檢測點抑制劑藥物。
◎《掘金創新藥》研究員認為,在剝離了大輸液、中藥飲品等業務之后,疊加獨家品種卡納琳拓寬應用范圍、具有持續增長動力,萊美藥業有望實現業績反轉。
每經記者 陳浩 每經編輯 魏官紅
《掘金創新藥》由每日經濟新聞聯合藥渡數據共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。

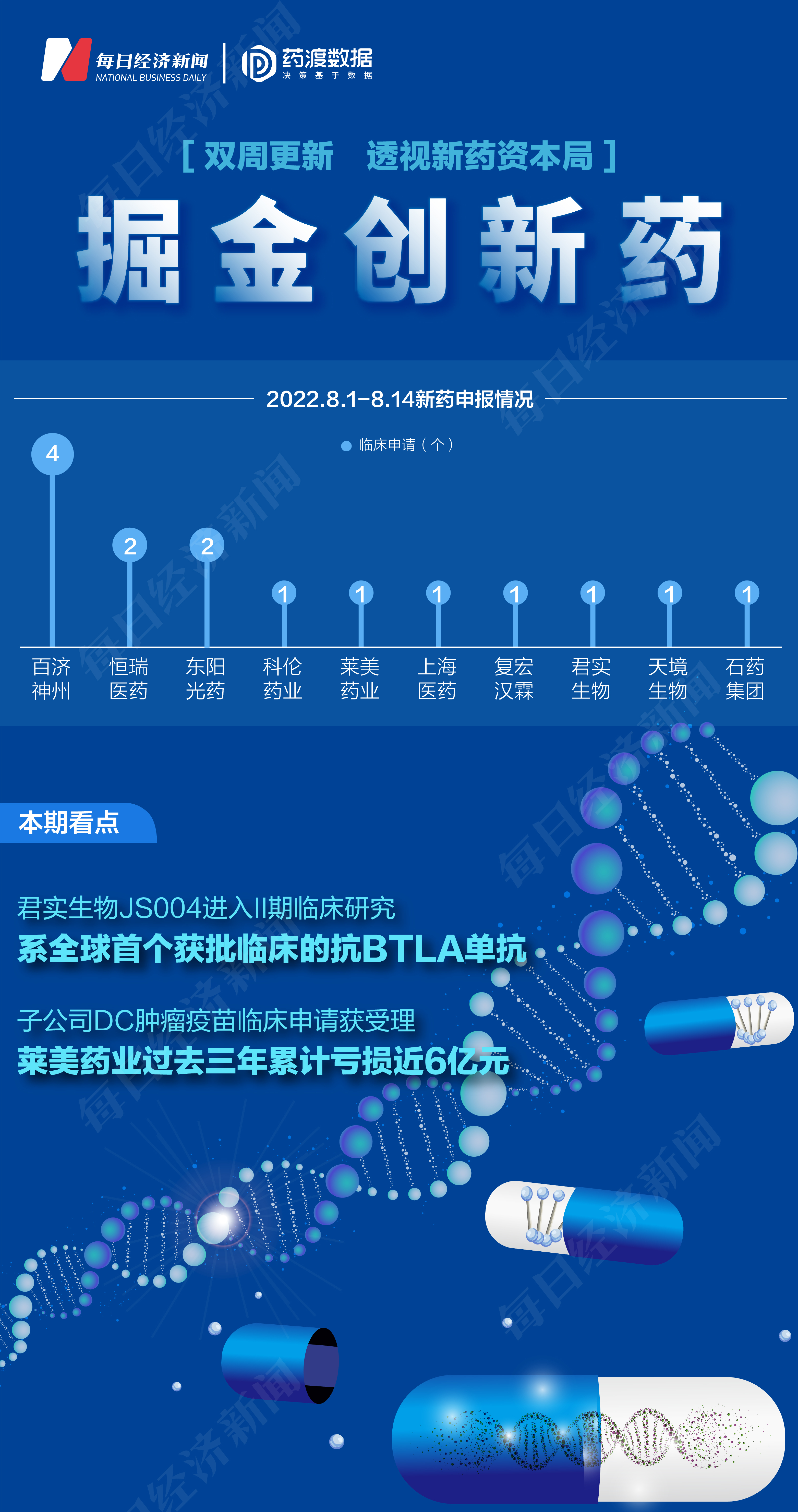
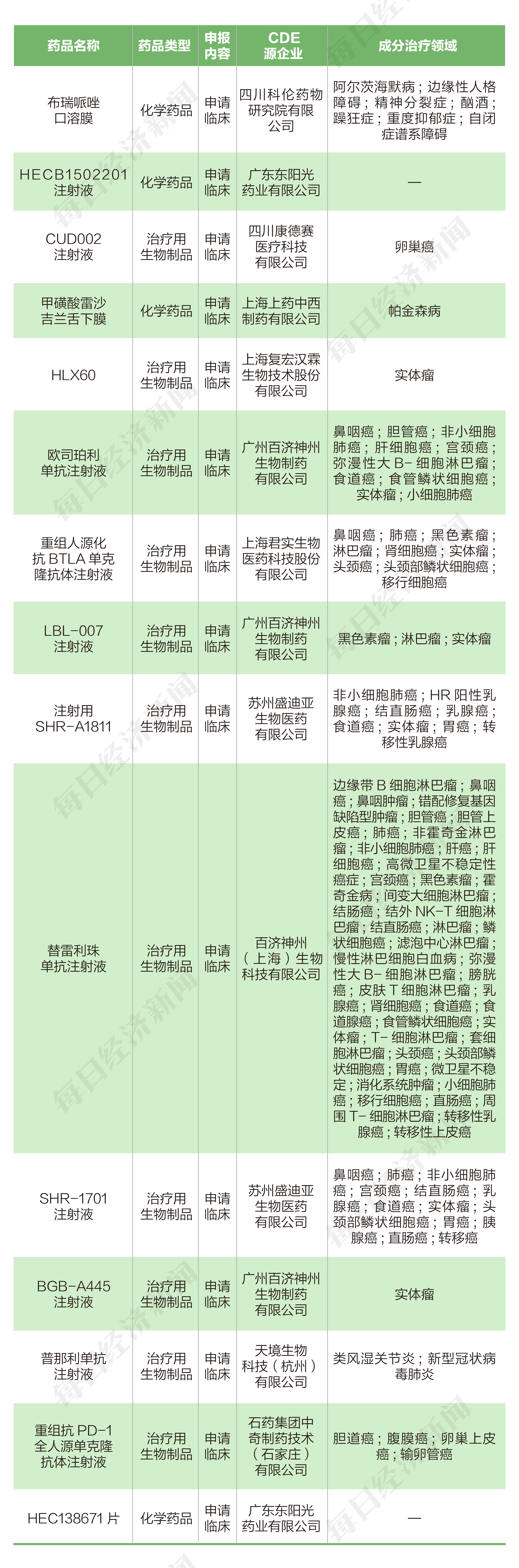
根據藥渡數據,2022年8月1日至2022年8月14日期間,國家藥品監督管理局藥品審評中心(CDE)共收到10家上市公司(含上市公司控股公司)提交的15個化學新藥、治療用生物制品新藥申請。

1.君實生物核心在研產品JS004進入II期臨床研究 系全球首個獲批臨床的抗BTLA單抗
8月8日,CDE官網顯示,君實生物(SH688180,股價58.80元,市值537億元)旗下的重組人源化抗BTLA單克隆抗體注射液(JS004)再度申報臨床。8月17日,《掘金創新藥》研究員從君實生物方面獲悉,目前該抗BTLA單抗已經進入中美兩地Ib/II期臨床研究階段。
JS004是君實生物自主研發的全球首個進入臨床開發階段的特異性針對B和T淋巴細胞衰減因子(BTLA)的重組人源化抗BTLA單克隆抗體。據悉,JS004擬開發適應證包括黑色素瘤、肺癌、淋巴瘤等。
行業洞察:
藥渡數據顯示,目前全球共有5款靶向BTLA的單抗藥物。其中,君實生物和禮來的藥物研發進展最快,均處于II期臨床研究階段。
在2022年美國臨床腫瘤學會(ASCO)年會上,君實生物公布了JS004單藥治療晚期實體瘤患者的Ia期劑量遞增研究結果,以及單藥或與特瑞普利單抗聯合治療復發/難治性淋巴瘤的I期研究結果。
公司點評:
過去兩年,君實生物最為資本市場所關注的,無疑是其新冠口服藥VV116的臨床研究進展。今年5月,君實生物披露了VV116三期臨床結果。公司稱,臨床研究結果顯示,VV116用于輕中度COVID-19的早期治療達到臨床方案預設的主要終點。不過,上述臨床結果并未得到廣泛認可。自今年5月12日股價達到高點以后,公司股價已經陰跌近三個月,目前股價較5月的高點已經腰斬。
君實生物目前仍未實現盈利,但過去三年,公司商業化能力已大幅提高,營收連年增長。2019年至2021年,公司營收分別為7.75億元、15.95億元和40.25億元。公司目前的核心商業化產品為PD-1產品特瑞普利單抗,截至今年7月,特瑞普利單抗的5項適應證已于中國獲批,其中已有3項適應證納入國家醫保目錄(2021年版)。此外,君實生物還對特瑞普利單抗開展了覆蓋超過15個適應證的30多項臨床研究。
特瑞普利單抗是中國首個批準上市的以PD-1為靶點的國產單抗藥物,但銷售一直不及預期,2021年銷售收入4.12億元。君實生物表示,2021年特瑞普利單抗銷量雖然有所提升,但未能實現“以價換量”,導致銷售收入出現負增長。
《掘金創新藥》研究員認為,一方面,PD-1競爭白熱化,特瑞普利單抗大適應證獲批后能給公司貢獻多少收入,還有待觀察;另一方面,公司新冠口服藥VV116也正在沖刺上市,但上市后有多大應用市場,也是未知數。接下來,君實生物還是要把研發重心放到更多First-in-class身上。
對于JS004來說,作為全球首個獲批臨床的抗BTLA單抗,如果后續臨床研究進展順利,JS004有望成為一款重磅的免疫檢測點抑制劑藥物。并且,JS004與特瑞普利單抗還具有聯合用藥潛力,未來其商業化拓展值得期待。國盛證券研報指出,JS004和特瑞普利單抗聯合療法是一種極具前景的抗癌治療策略,有望增加患者對免疫治療的反應,擴大免疫治療的受益人群。
2、萊美藥業子公司DC腫瘤疫苗臨床申請獲受理 上市公司三年累計虧損近6億元
8月11日,CDE官網顯示,四川康德賽醫療科技有限公司(以下簡稱康德賽醫療)的1類新藥CUD002注射液臨床申請獲得受理,這也是CUD002注射液首度申報臨床。康德賽醫療為萊美藥業(SZ300006,股價4.13元,市值44億元)控股子公司,截至2021年底,上市公司持有康德賽醫療37.17%股權。
公開資料顯示,CUD002注射液是康德賽醫療自主研發的一款個體化的腫瘤疫苗,其根據患者獨特的突變信息定制設計并制造,適用于卵巢癌,擬作為腫瘤切除后的輔助治療。它能激發患者自身免疫系統對卵巢癌相關抗原和新生抗原產生免疫反應并殺傷腫瘤細胞,從而減少復發,以期根除腫瘤。
行業洞察:
2010年,丹麥藥企的一款DC疫苗獲FDA批準上市,用于治療前列腺癌。如今,全球范圍內已經有多款DC疫苗獲批上市,適應證涉及多種癌癥,包括前列腺癌、惡性黑色素瘤、腎細胞癌、非霍奇金淋巴瘤、腦膠質瘤等。
CUD002注射液則是中國首款基于腫瘤新生抗原的mRNA編輯DC腫瘤治療性疫苗,有望開拓國內實體腫瘤的細胞免疫治療新領域。
公司點評:
萊美藥業是首批創業板上市公司之一,2009年上市時,公司產品主要涵蓋抗感染類和特色專科用藥兩大系列。目前,公司兩大核心產品為納米炭混懸注射液(卡納琳)和艾司奧美拉唑腸溶膠囊(萊美舒),其中,卡納琳是唯一獲得前CFDA批準的淋巴示蹤劑,萊美舒則是首家上市國產艾司奧美拉唑口服制劑。
上市以后,萊美藥業通過多輪并購投資,介入大輸液、中藥飲片等領域,但這些業務實質效果不佳。自2019年開始,萊美藥業開始陷入連續虧損的狀態,過去三年(2019年~2021年)累計虧損約6億元。公司在2019年和2020年計提了大量資產減值,2021年上半年,公司處置了中藥飲片、大輸液等非核心業務。
在2021年第五批國家集采中,公司的萊美舒成功中標,不過,其在2021年未能實現以價換量,萊美舒銷量及銷售單價大幅下降。
值得注意的是,2020年,中恒集團入主萊美藥業,廣西國資委成為公司實控人。隨后,萊美藥業得以重新梳理主業,剝離了大輸液、中藥飲片等業務,重新聚焦公司自身的特色專科藥,發展抗腫瘤、甲狀腺、眼科用藥等領域。
《掘金創新藥》研究員認為,在剝離了大輸液、中藥飲品等業務之后,疊加獨家品種卡納琳拓寬應用范圍、具有持續增長動力,萊美藥業有望實現業績反轉。但對于子公司剛剛申報臨床的DC腫瘤疫苗來說,作為一項前沿性的腫瘤免疫治療研究,未來的臨床試驗注定是一段漫長的旅程,具體進展如何仍待觀察。
封面圖片來源:攝圖網-501080841
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
