每日經濟新聞 2023-08-31 07:29:34
◎需要指出的是,盡管填補了相關治療領域的空缺,但舒沃替尼所針對的EGFR Exon20ins突變并不是一個非常大的適應癥。弗若斯特沙利文數據預計,到2023年全球EGFR exon20ins突變型NSCLC新發患者數量將達到8.6萬人,其中我國患者有4.2萬人。
每經記者 許立波 每經編輯 張海妮
8月29日,創新藥企業迪哲醫藥(SH688192,股價33.02元,市值134.77億元)披露2023年半年度報告,報告期內,公司尚未有產品上市銷售,未實現營收;歸母凈虧損為5.14億元。上半年研發投入3.43億元,同比增長4.2%;研發人員數量也由上年同期的181人增長至238人,占公司總人數的56.13%,其中接近四分之三的研發人員為碩士及以上學歷。
迪哲醫藥稱,報告期歸屬于上市公司股東扣除非經常性損益前后的凈虧損較上年同期增加較多,主要原因系除研發項目進一步加大投入以外,公司為第一款產品舒沃替尼上市提前進行商業化布局,于2022年下半年開始加快組建商業化團隊,為產品上市做前期商業化籌備工作。
同時,為吸引并激勵員工,公司于2022年12月授予部分人員第二類限制性股票,故報告期內股份支付費用相應增加。報告期末歸屬于上市公司股東的凈資產及總資產較上年末下降,主要原因系上述費用穩步增加。
資料顯示,迪哲醫藥是一家全球創新型生物醫藥企業,專注于惡性腫瘤和免疫性疾病領域。公司前身為阿斯利康亞洲研發中心,于2017年10月獨立運營,核心研發團隊成員來自原阿斯利康亞洲研發中心。
半年報披露,截至報告期末,阿斯利康(AstraZeneca AB)和先進制造產業投資基金(有限合伙)持股比例均為26.69%,并列上市公司第一大股東。
與國內一眾本土Biotech(生物科技公司)所不同的是,迪哲醫藥的外資藥企基因令其將眼光更多放到了全球市場。財報稱,公司以推出全球首創藥物(First-in-class)和具有突破性潛力的治療方法為目標,旨在填補全球未被滿足的臨床需求。公司已建立了具備全球競爭力的產品組合,所有產品均享有完整的全球權益,并采用全球同步開發的模式。
截至半年報披露日,迪哲醫藥的產品管線中,1款藥物已在國內獲批上市,2款藥物處于全球注冊臨床階段,共5款藥物處于國際多中心臨床階段,并儲備了多個處于臨床前研究階段的候選創新藥物。
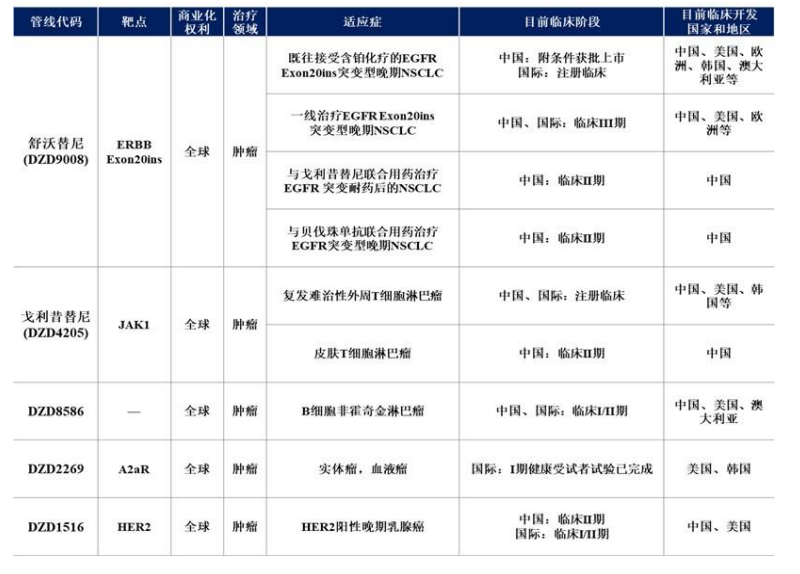
迪哲醫藥研發管線 圖片來源:公司半年報
其中,核心在研產品舒沃替尼是公司自主研發的特異性表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI),已于今年8月在中國獲批上市。
迪哲醫藥此前披露的公告顯示,肺癌是我國發病率和死亡率最高的惡性腫瘤,其中EGFR是NSCLC(非小細胞肺癌)最常見的驅動基因突變類型。EGFR Exon20ins突變是最常見的EGFR罕見突變類型,約占EGFR突變的12%,因其空間構型特殊,異質性強,一直以來缺乏安全有效的靶向治療手段,是亟需解決的臨床痛點。
在可選擇的藥物方面,在舒沃替尼獲批前,僅有強生的Amivantamab(埃萬妥單抗)和武田的Mobocertinib(莫博賽替尼)兩款,其中后者于2023年1月在國內獲批上市,但相比較于舒沃替尼,這兩款藥物的療效較為有限。
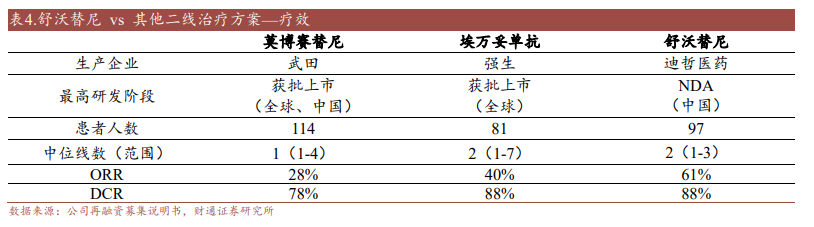
圖片來源:財通證券研報
JAK1抑制劑戈利昔替尼也是目前迪哲醫藥研發進展較快的一款產品, 8月29日,中國國家藥監局藥品審評中心(CDE)官網公示,公司戈利昔替尼膠囊擬納入優先審評,擬定適應癥為:既往至少接受過一次標準治療的復發或難治的外周T細胞淋巴瘤(r/r PTCL)成人患者。
DZD8586是迪哲醫藥自主研發的具備穿透血腦屏障能力的高選擇性靶向小分子抑制劑,用于治療復發或難治性B細胞非霍奇金淋巴瘤(r/r B-NHL),目前正在開展國際多中心I/II期臨床試驗。報告期內,DZD8586的初步臨床研究結果在2023 ICML(國際惡性淋巴瘤大會)大會發表。
今年8月23日,國家藥品監督管理局(NMPA)官網顯示,國家藥監局附條件批準迪哲醫藥申報的1類創新藥舒沃替尼片(商品名:舒沃哲)上市,用于既往經含鉑化療治療時或治療后出現疾病進展,或不耐受含鉑化療,并且經檢測確認存在表皮生長因子受體(EGFR)20號外顯子插入突變的局部晚期或轉移性非小細胞肺癌的成人患者。至此,迪哲醫藥擁有了首款商業化產品。
迪哲醫藥創始人、董事長兼首席執行官張小林評價稱,舒沃替尼的上市標志著公司完成了從研發到商業化的躍遷。
或許也是迪哲醫藥的外資基因以及全球同步開發模式起到了作用,舒沃替尼在中美兩國臨床推進及藥物審評審批的過程中都可謂“順風順水”,舒沃替尼從開展臨床試驗患者入組到獲批上市,僅用了不到4年,并分別于2020年和2022年獲得中國、美國相關適應癥的“突破性療法資格認定(BTD)”。除了多項臨床研究結果入選ASCO(美國臨床腫瘤學會)、CSCO(中國臨床腫瘤學會)大會報告,還被業界冠以“迄今為止肺癌領域唯一一個獲中美雙突破性療法認定的國創新藥”之名。
需要指出的是,盡管填補了相關治療領域的空缺,但舒沃替尼所針對的EGFR Exon20ins突變并不是一個非常大的適應癥。弗若斯特沙利文數據預計,到2023年全球EGFR exon20ins突變型NSCLC新發患者數量將達到8.6萬人,其中我國患者有4.2萬人。
天風證券在研報中測算稱,預計舒沃替尼于中國上市后前三年(2023-2025年)收入分別為1.47億元、4.90億元和5.26億元,于美國上市后前三年(2024-2026年)收入分別為0.06億美元、0.12億美元和0.69億美元。疊加歐盟市場,天風證券預計2023-2025年舒沃替尼全球市場收入分別將達到1.47億元、6.23億元和7.48億元。
在臨床階段頭頂“明星產品”光環的舒沃替尼,能否在商業化上延續之前的高光表現,仍有待后續觀察。
8月30日,《每日經濟新聞》記者也向迪哲醫藥方面詢問了有關舒沃替尼上市后的商業化策略及產能建設等問題。
迪哲醫藥內部人士回復記者稱,現階段,公司將采取藥品上市許可持有人(MAH)的方式進行舒沃替尼的生產,公司和委托加工合作方(即藥明康德子公司合全藥業)已分別獲得藥品生產許可證的相關資質,為后續的商業化生產做好了準備。銷售方面,目前公司正在國內搭建銷售團隊,核心成員深耕肺癌和血液瘤領域多年,打造了一支兼具跨國藥企和中國創新藥企經驗的商業化團隊,國內市場將由公司自己的銷售團隊負責,海外市場公司也正在積極評估對外合作的機會。
未來,迪哲醫藥也計劃落地產線實現自主生產,在今年披露的26億元定增預案中,公司本次募投項目擬建設1條片劑生產線和1條膠囊生產線,建設完成后可實現7000萬片劑和2000萬粒膠囊年產能,主要生產舒沃替尼、戈利昔替尼及DZD8586。
至于舒沃替尼的銷售預期及產能規劃等問題,上述人士稱,因未來銷售存在不確定性、涉及商業機密等原因,不方便對外透露。
封面圖片來源:視覺中國-VCG21gic6332800
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
