每日經濟新聞 2023-12-28 08:59:30
◎ 瑞典公共衛生局微生物學研究員米拉齊米告訴《每日經濟新聞》記者,mRNA技術與CRISPR基因編輯技術的結合可能是未來探索的潛在路徑之一。
每經記者 文巧 每經編輯 蘭素英
隨著mRNA新冠疫苗的成功推廣,mRNA(信使核糖核酸)技術獲得了前所未有的關注,也收獲了資本市場的青睞。
以行業龍頭公司Moderna和BioNTech為例,據Companies Market Cap數據,截至2023年12月26日,Moderna的市值從2020年年初的65.8億美元飆漲至361.8億美元,BioNTech的市值也從76.8億美元升至252.5億美元,漲幅分別超440%和220%,而同期納指的漲幅約為66%。
今年的諾貝爾生理學或醫學獎更是頒給了科學家卡塔琳·卡里科和德魯·韋斯曼,表彰他們在mRNA研究上的突破性發現,進一步放大了這一技術的價值。有醫療專家如此描述道,mRNA疫苗技術落地是人類文明史上的又一次“盜火”,這預示著其可能會帶來生物醫藥領域的巨變。
有數據表明,2023年-2028年期間,mRNA疫苗和療法市場規模將以16.8%的復合年均增長率快速增長,預計在2028年達到1018億美元。
《每日經濟新聞》記者注意到,包括阿斯利康、葛蘭素史克、默克、禮來、賽諾菲、輝瑞等跨國醫藥巨頭已經在相關產業加大布局投資。亞太地區有超過60%的疫苗制造商亦有意愿改造或建立新設施,尤其是與mRNA技術相關的設施。
當前,科學家們正在積極探索mRNA技術的未來,希望能夠改變人類未來治療和預防多種疾病的方式。mRNA技術又將如何實現這一突破?又還面臨著哪些技術難題?帶著這些疑問,《每日經濟新聞》記者采訪到瑞典卡羅林斯卡醫學院實驗醫學系教授、瑞典公共衛生局微生物學研究員阿里·米拉齊米,以及不列顛哥倫比亞大學生物醫學工程學院教授安娜·布萊克尼。
人體依靠數百萬種微小的蛋白質來維持自身的生命和健康,并利用mRNA來告訴細胞制造哪些蛋白質。在卡里科曾經的設想中,從理論上講,如果能夠設計mRNA,人體內就擁有了一個蛋白質制造工廠,可以制造任何想要的蛋白——抗感染的疫苗或抗體,治療罕見疾病的酶,或是修復受損組織的生長劑。
隨著mRNA新冠疫苗的成功推廣,mRNA技術已遠不止于疫苗開發,科學家們現在將注意力轉向mRNA 技術的未來,布萊克尼和米拉齊米都認為,該技術有潛力改變人類未來治療和預防多種疾病的方式。
卡羅林斯卡醫學院科學家于2022年11月發表在《自然》上的一篇論文寫道,與蛋白質藥物相比,mRNA的真正附加價值是合成高水平細胞內蛋白質的能力,這使其能夠直接靶向一些在臨床技術上很難用蛋白質藥物治療的代謝疾病,或將其應用于緊急護理中,以幫助有急性衰弱和危及生命的疾病的患者。
鑒于mRNA幾乎可以在全身或局部產生任何蛋白質,目前科學界正在研究廣泛的潛在疾病適應癥。布萊克尼向記者說道,“mRNA在癌癥疫苗、免疫療法、蛋白質替代、基因編輯等方面的應用上都有巨大的潛力,這些也是該領域目前正在探索的方向。”
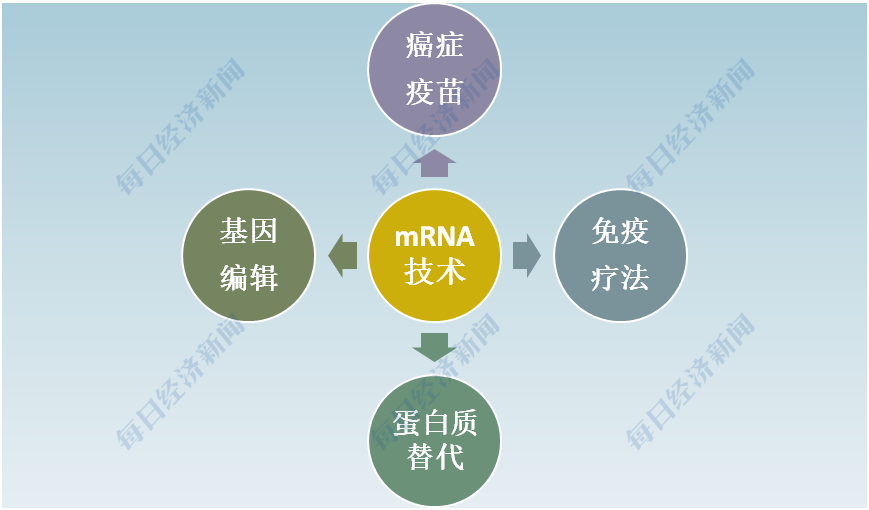
mRNA技術的潛在應用領域 圖片來源:每經編輯蘭素英制圖
談及基因編輯,米拉齊米認為,mRNA技術與CRISPR基因編輯技術的結合可能是未來探索的潛在路徑之一。“我一直在探索結合使用CRISPR/Cas9基因編輯技術和mRNA技術,這可能為對抗復雜疾病的未知療法打開了大門。”
《每日經濟新聞》記者查詢發現,一項由mRNA編碼的CRISPR-Cas9基因編輯技術治療遺傳性淀粉樣變性疾病ATTR的試驗在2023年年底啟動三期試驗。在此前的試驗中,該療法在安全性和有效性方面已經取得了令人鼓舞的結果。
上述論文表示,這項試驗的結果將支持探索CRISPR-mRNA療法對涉及中間代謝缺陷和脂蛋白疾病的多種遺傳性肝病的潛在擴展,未來可能會應用于其他實體器官,例如心臟、腎臟和中樞神經系統等。
此外,布萊克尼認為,mRNA 技術的另一大潛力在于提高現有疫苗(如流感疫苗)的功效,“如果我們能夠像用該技術合成流感疫苗,那么將大大減少生產所需的時間。如此,我們有可能實時監測流感病毒,并在一個冬天開發出3~4種更有效的疫苗株。”
“mRNA平臺有很好的臨床數據結果,已經很有說服力。這個平臺的優勢是非常快、非常靈活,你不需要細胞就可以合成(mRNA)。”阿里·米拉齊米告訴《每日經濟新聞》記者。“我相信,它對于癌癥治療,以及一些其他的遺傳疾病都可以適用。如今,這個平臺實際上已經開始針對癌癥治療進行研究,一些研究已經進行到二期和三期試驗的步驟。”
“未來,我認為我們很快會開發出針對其他傳染病和癌癥的mRNA疫苗。”布萊克尼如此說道。
每經記者注意到,Moderna正在開發針對 RSV、HIV、寨卡病毒、Epstein-Barr 病毒等的mRNA疫苗,該公司計劃在未來五年內推出多達15種新產品,并將多達50種mRNA藥物推進至臨床試驗階段。BioNTech也在探索用于結核病、瘧疾、艾滋病毒、帶狀皰疹和流感的疫苗。除此之外,兩家公司還致力于將mRNA技術用于癌癥治療。
目前,全球有幾十項臨床試驗與mRNA腫瘤疫苗有關,涉及黑色素瘤、胰腺癌、結直腸癌等。今年2月,Moderna與默沙東的腫瘤新抗原mRNA疫苗mRNA-4157與PD-1抗體聯合輔助治療高危黑色素瘤,獲FDA的突破性療法認證,這是全球首個獲此認證的mRNA腫瘤疫苗。
回顧mRNA疫苗的發展歷程,安娜·布萊克尼告訴《每日經濟新聞》記者,“當我開始研究RNA 疫苗時,業內外對于mRNA疫苗的有效性仍然存在很多懷疑,更不用說自擴增式RNA疫苗了。盡管我認為mRNA技術最終會取得成功,但如果不是新冠疫苗的推動,它可能還需要更長的時間。”
阿里·米拉齊米也在采訪中對記者稱,“大流行的確加快了mRNA疫苗的推廣進程,盡管我相信這種疫苗早已經是試驗中的候選疫苗了。”
科學家卡塔琳·卡里科和德魯·韋斯曼在今年摘得諾貝爾生理學或醫學獎桂冠,也充分說明了mRNA技術對人類的價值。
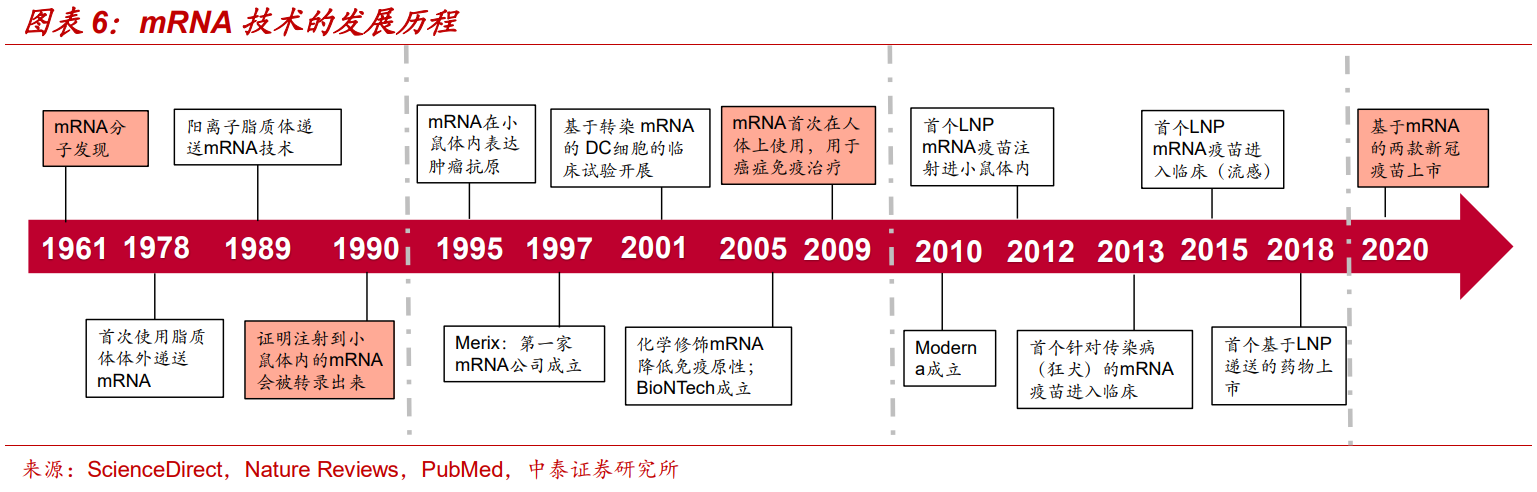
圖片來源:中泰證券研究報告
“mRNA新冠疫苗在大流行期間能得以快速推廣的原因是開發速度較快(值得注意的是,開發速度與試驗速度是不同的)。與傳統方法相比,設計和制造mRNA疫苗要簡單得多。由于這些疫苗高度安全、有效且率先上市,因此獲得了成功。”布萊克尼對每經記者說道。
新冠疫情催生了mRNA疫苗市場的快速增長。根據研究公司 Roots Analysis的數據,2020 年,鑒于新冠大流行帶來的迫切需求,專注mRNA 疫苗和療法開發的公司投資超過52億美元,遠高于2019年的5.96 億美元。
mRNA疫苗研發企業也在二級市場大放異彩。以該領域的龍頭企業Moderna和BioNTech為例,2020年年初迄今,Moderna股價漲幅已經超過385%,BioNTech股價在此期間的漲幅超過215%。
新冠疫情消退之后,市場的目光開始聚焦在更多mRNA疫苗和相關藥物療法上。據中信證券研報測算,mRNA預防性疫苗有望在2025年503億美元疫苗市場中達到20%滲透率,對應市場規模101億美元;mRNA腫瘤疫苗有望在2025年達到0.5%滲透率,對應市場規模105億美元;mRNA蛋白替代療法有望取代部分蛋白藥物市場,預計對應市場規模為66億美元。

圖片來源:中信證券研究報告
國際市場研究和咨詢公司Mordor Intelligence的報告數據則透露出該市場更廣闊的前景。數據顯示,mRNA疫苗和療法市場規模在2023年將達到468.3億美元,之后將以16.8%的復合年均增長率快速增長,在2028年預計將達到1018億美元。報告顯示,受研發和投資增加、新產品推出以及慢性病數量增加等因素影響,北美地區當前仍是主要的市場,但亞太地區未來的發展潛力十分強勁。
據上述報告,目前mRNA疫苗和療法市場的主要玩家包括輝瑞、Moderna、BioNTech、葛蘭素史克、第一三共。其他市場參與者包括阿斯利康、默克、禮來、賽諾菲等全球醫藥巨頭,以及CureVac、Arcturus Therapeutics、Translate Bio和Argos Therapeutics等生物科技初創公司。
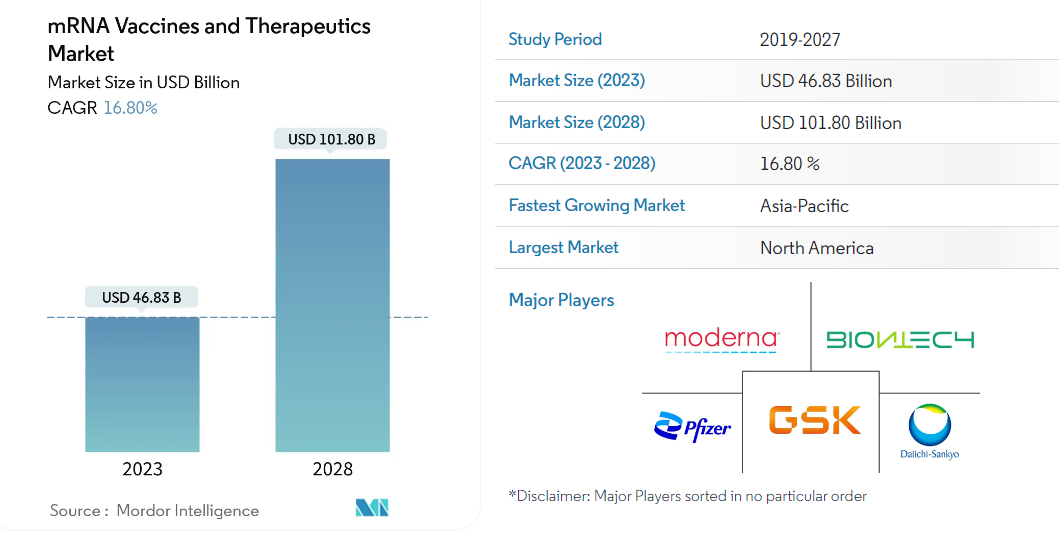
圖片來源:Mordor Intelligence網站
自2021年以來,全球醫藥巨頭都在積極實施各種戰略以增強自身在mRNA領域的實力。舉例來說,2023年4月,Moderna與IBM合作探索下一代技術,包括量子計算和人工智能,以推進和加速mRNA研究和科學;6月,加拿大醫藥巨頭Providence Therapeutics與加拿大健康研究機構宣布合作開發基于mRNA的疫苗和療法。
在mRNA之外,更大的RNA藥物療法領域也受到了投資界的青睞,包括小干擾RNA(siRNA)、核酸適配體(RNA aptamer)和轉運RNA(tRNA)等。
據醫藥生物技術平臺公司藥明康德的內容團隊不完全統計,2019年~2023年,全球RNA藥物領域共發生超過400起融資事件;截至2023年11月,一共發生76起融資事件,其中,有37起融資突破1億元人民幣,破億融資事件占比接近50%。
據悉,2023年,該領域超過一半(55%,42起)是早期融資事件(A輪及A輪前),總融資金額比2022年提高了24%,達到79億元,有望超越2021年的融資水平。目前該領域單筆最高融資也來自ReNAgade Therapeutics的超3億美元A輪融資。
盡管市場前景廣闊,但當前mRNA療法的開發和推廣仍然還面臨著不小的挑戰。布萊克尼對《每日經濟新聞》記者表示,“對于mRNA療法的開發,我預計還將需要更多時間,因為在涉及免疫原性和劑量的問題上仍然存在很大的問題。”
卡羅林斯卡醫學院科學家在《自然》上發表的論文中也提到了這一點問題,“mRNA 固有的免疫原性雖然增強了其作為疫苗的功效,但阻礙了其作為治療劑的使用,因為治療劑需要更高水平的蛋白質表達。”
具體來講,通過注射疫苗產生免疫反應只需要最少量的蛋白質(mRNA),因為免疫系統可以通過細胞介導和抗體介導的免疫顯著放大抗原信號。但相比之下,通過mRNA療法來治療其他疾病則需要高達1000倍的蛋白質水平才能達到治療閾值。
另一方面,論文提到,治療劑量高度依賴于給藥途徑。在許多情況下,mRNA療法必須要有特定的靶途徑、細胞、組織或器官,這意味著靶細胞的攝取效率將非常重要,因為其決定了蛋白質表達的持續時間和水平。除了肝臟(常用的靜脈注射靶向器官)之外,如何將mRNA有效遞送到實體器官仍然具有挑戰性。實現 mRNA 療法的全部潛力將需要更先進的體內遞送系統,特別是對于心臟、腎臟、大腦和肺等實體器官。
這就提出了有關臨床靶點設計的難題。布萊克尼表示,“當前開發mRNA技術最主要的挑戰還包括設計RNA(的靶點)和遞送系統,以按所需方式激活或不激活免疫系統,基本上每種疫苗和療法的情況都不同。”
據《麻省理工學院科技評論》的一篇文章,癌癥疫苗的制造比較困難,部分原因是,當人體細胞形成腫瘤時,通常沒有像新冠病毒上的刺突蛋白那樣明確的蛋白質靶標。
在布萊克尼看來,對于艾滋病毒來說,找到良好靶標也存在難度。“科學家還從未發現針對艾滋病毒能夠誘導有效免疫反應的蛋白質(靶標)。”
“在技術方面,RNA和相關制劑的質量控制仍然存在挑戰。我們還需要有更多的時間才能夠更好地理解該技術的系統和結構功能關系。”布萊克尼告訴《每日經濟新聞》記者。“安全性也是臨床試驗不可或缺的一個方面。實際上,mRNA 疫苗的首次臨床試驗已于十多年前開始,因此我們確實擁有長期的安全性數據。”
“總的來說,我認為mRNA技術的好處在于它的開發速度相對較快且制造成本低廉,我希望全球范圍內能更公平地獲得這些藥物。”她總結道。
封面圖片來源:視覺中國-VCG11385119793
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
